2024年10月中旬,第90届中国国际医疗器械博览会在深圳国际会展中心成功举办。作为医疗科技领域的顶级盛会,本届博览会以“创新科技 智领未来”为主题,与来自世界各地的医疗精英与专业人士共同探讨医疗器械行业的未来发展路径。在这场科技与智慧的碰撞中,Kiwa以其深厚的行业积淀,向全球医疗行业传递MDR法规的最新动态与合规要求,为全球医疗器械供应商提供宝贵的经验与启示,不仅彰显了其对行业发展趋势的敏锐洞察与积极响应,更体现了其作为全球TIC行业引领者的责任与担当。

Kiwa专业解读,掀起MDR 法规研讨热潮
医疗器械博览会致力于打造一场跨越传统与未来的医疗科技盛宴,医疗器械企业代表与行业精英齐聚,来自全球各地的4000余家医疗品牌企业,数万款产品与超12万名专业观众共话医疗器械行业发展议题。
Kiwa作为MDR公告机构,在与广大医疗行业企业合作中整合优势资源,广泛积累经验。Kiwa Cermet 意大利,Kiwa 土耳其和Kiwa DARE 荷兰作为 TEAM-NB 欧洲医疗器械领域公告机构协会成员在各国医疗器械合规发展中发挥了巨大作用,得到了行业广泛认可。其中Kiwa土耳其(Kiwa NB1984)更是做过数千种医疗器械产品的认证,深受客户信赖。

展会期间,Kiwa进行了以《MDR法规下的供应商合规管理》为主题的演讲,强调MDR法规(欧盟医疗器械新法规)是医疗器械产品在欧盟境内销售的强制性前置条件,产品获得MDR认证后不仅可以在欧盟境内销售,还可以在中东地区、东南亚、南美、非洲、澳大利亚等地区进行互认注册。并且,演讲中还剖析了MDR法规对医疗器械供应商合规管理的要求与挑战,分享了MDR法规下企业加强合规管理的实践经验和成功案例。

Kiwa携手并进,引领医疗器械行业合规新未来方向
Kiwa深谙医疗与人类健康紧密攸关,密切关注医疗器械企业的实际需求与核心问题,同时深入理解MDR标准,坚持立足医疗企业发展形势,为医疗器械企业提供专业高效的MDR服务,服务范围现已涵盖有源诊断、有源治疗、骨科植入物、牙科植入物、功能植入物、动物源器械、带药器械、可吸收器械、Annex XVI非专业用医疗器械、耗材等,为众多行业企业的发展提速提质创造良好条件。
MDR法规发布后,Kiwa资深专家从不同视角深度研究MDR法规,明确MDR对医疗器械产品的质量、有效性、安全性等提出了更高标准要求,是医疗器械行业标准化、合规化、快速化发展的前提,并立足MDR法规快速完善服务体系,提升服务能力。

随着MDR法规的全面实施,医疗器械供应商面临着前所未有的合规挑战。Kiwa深知,唯有深刻理解才能有效应对这些挑战。在第90届中国国际医疗器械博览会上,Kiwa深入剖析了MDR法规对医疗器械企业提出的严格要求,也强调了MDR认证对于产品国际市场推广的重要性。同时,作为致力于助力医疗企业打开更为广阔的市场空间,Kiwa坚守品牌核心价值,以更加开放和创新的姿态,携手全球医疗行业伙伴,共同应对挑战,把握机遇,共绘医疗科技新篇章。
 第90届CMEF:Kiwa(琦威)聚
第90届CMEF:Kiwa(琦威)聚  三甲医院新标配:三雄极光 风口集成灯
三甲医院新标配:三雄极光 风口集成灯  乳腺癌防治月:你关心的乳腺癌防治问题
乳腺癌防治月:你关心的乳腺癌防治问题  年底“冲业绩”,这波活动得码好
年底“冲业绩”,这波活动得码好  2025年起职工养老保险增加病残津贴
2025年起职工养老保险增加病残津贴 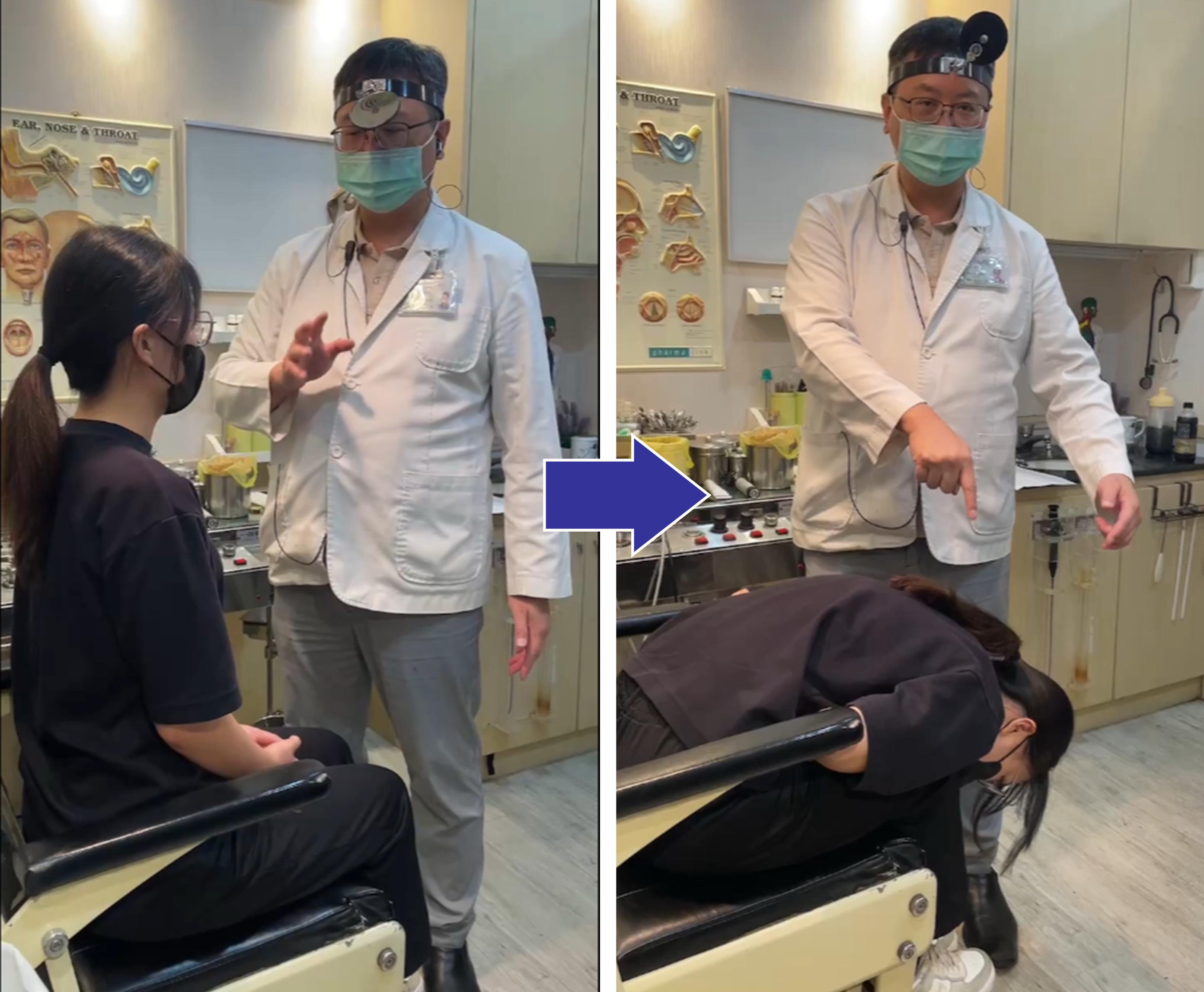 台湾眩晕权威谈罕见耳疾:快速减重恐引
台湾眩晕权威谈罕见耳疾:快速减重恐引  世界乳腺癌防治月:乳腺癌防控新趋势—
世界乳腺癌防治月:乳腺癌防控新趋势—  又暖又燃!武汉市武东医院“世界精神
又暖又燃!武汉市武东医院“世界精神  惊喜跨界,旖飞冲天——锦波生物“薇旖
惊喜跨界,旖飞冲天——锦波生物“薇旖  我国在医疗领域开展扩大开放试点工作
我国在医疗领域开展扩大开放试点工作  2024首场保妥适注射医师培训会辉煌
2024首场保妥适注射医师培训会辉煌  眩晕权威警示:慢性头痛或为内颈动脉狭
眩晕权威警示:慢性头痛或为内颈动脉狭 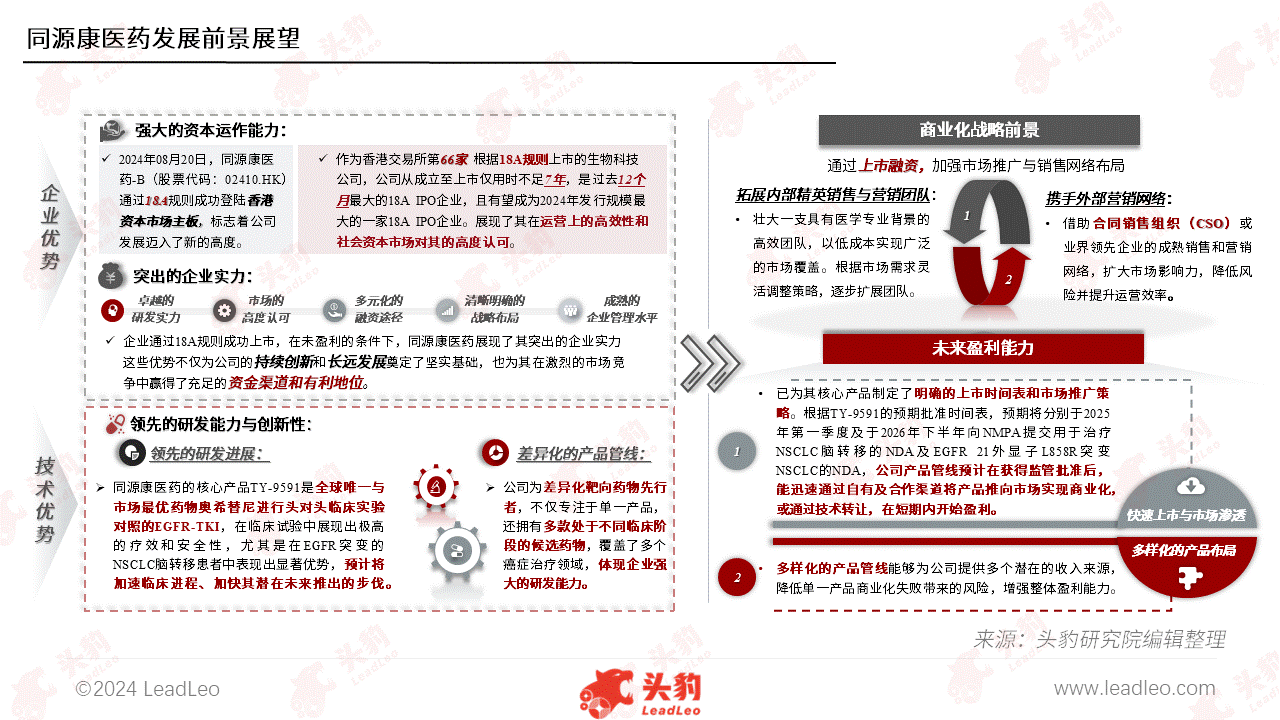 头豹研究院发布《2024年中国小分子
头豹研究院发布《2024年中国小分子  儿童肥胖不可忽视
儿童肥胖不可忽视  第五届 CAAE 结节性硬化症学术会
第五届 CAAE 结节性硬化症学术会 



 网上买减肥药,美容院打减肥针 减重你
网上买减肥药,美容院打减肥针 减重你