17分!Cell子刊:NGS结合类器官药敏试验准确预测肺癌患者临床疗效

导语
肺癌是死亡率第一位的恶性肿瘤,尽管基因检测指导下进行的分子靶向治疗可延长晚期肺癌患者的总生存并改善生活质量,但也带来了新的问题。驱动基因阳性晚期肺癌患者有多个靶向药物可选的情况下,何者是最优选择?靶向治疗后耐药机制不明的患者,选择哪种治疗方案克服耐药性?NGS检测结合体外3D类器官模型(具有和来源组织高度一致的遗传特征和形态结构,实现部分器官功能,被誉为“患者替身”)的联合应用,使得患者有可能通过体外药敏试验来预知自身接受靶向和化疗的临床疗效。
广东省人民医院/广东省肺癌研究所杨衿记教授团队,首次基于晚期肺癌患者的恶性体液样本(MSE)或肿瘤组织构建大样本体外3D肺癌类器官(Lung Cancer Organoids,LCOs)模型,通过基因检测全面分析起源组织及LCOs的分子突变图谱后,进行类器官药物敏感性测试,与临床治疗疗效对比,验证了类器官药物敏感性测试(LCO-DST)在指导临床用药中的准确性及重大价值。研究成果已发表在Cell 子刊Cell Reports Medicine(IF=16.988)。
研究亮点
1、国际上肺癌类器官领域最大样本量真实世界研究(162例样本)。
2、通过NGS检测证明类器官样本与同源肿瘤组织样本的基因组测序结果具有较好的一致性。
3、类器官药敏试验模型可作为指导肺癌患者个性化靶向或化疗方案选择的预测模型。
4、NGS联合类器官药敏试验可准确预测晚期肺癌患者抗肿瘤治疗的临床疗效。
研究设计
本研究构建了晚期肺癌患者的组织和恶性积液(MSE)样本来源的LCOs模型,并通过HE、IHC以及NGS等方法分析LCOs和来源样本的组织病理及遗传特征。研究通过基于LCOs模型的药物敏感性实验测试了LCOs模型对靶向或化疗药物的敏感性以及LCO-DST结果与临床疗效的相关性(图1)。
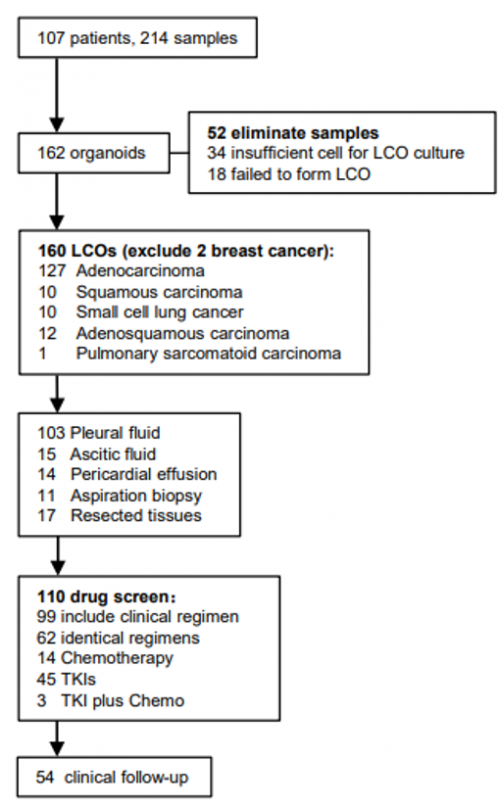
图1. 研究思路
研究结果
NGS检测证明MSE和MSE来源的LCOs基因组突变图谱一致
本研究收集了107例局部晚期或转移性肺癌患者的214例样本进行类器官建模,成功地培养了162例类器官,总成功率为75.7%(162/214),MSE来源的类器官成功率达81.5%(132/162),显著高于肿瘤组织来源的57.7%(30/52)。为了确保体外模型可以充分反映原始肿瘤的病理表型和基因型,本研究进行了病理学和基因组学的验证,H&E和IHC染色结果显示,类器官样本与同源的临床样本一致率为77.6%(59/76)。
通过对部分LCOs和起源组织进行NGS大Panel检测发现:以匹配的MSE基因组作为参照,类器官样本所有体系突变的敏感性达到 70.1%,特异性为97.7%。进一步对TMB进行分析发现,基于LCO样本计算的TMB与基于MSE样本计算的TMB显著正相关(Pearson’s r=0.68,p=0.02)(图2)。以上结果证明了类器官可以充分反映其同源组织的病理表型、遗传背景和基因表达谱。
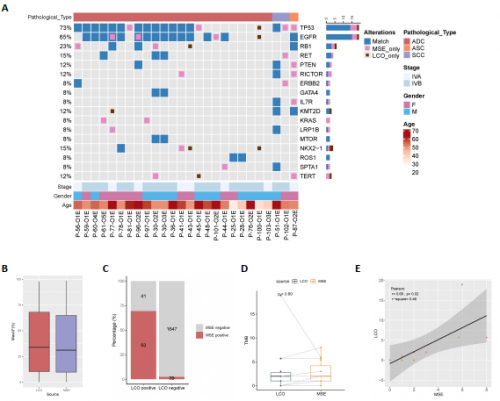
图2. MSEs与LCOs样本的基因组突变谱及TMB结果一致性
LCO-DST的稳定性和异质性
为了研究LCOs模型体外药物反应的稳定性,研究者收集了同一位患者不同时间点的样本分别构建LCOs,并进行药敏实验。结果显示,不同采样间隔(1-9天)的MSE样本不影响LCOs模型的构建,不同采样间隔LCOs样本基因组图谱一致性可达到81.25%(图3A),LCO-DST结果显示不同采样间隔LCOs样本对药物的响应程度一致(图3B)。此外,肿瘤异质性对于临床治疗是一项挑战,为更全面地描述肿瘤的异质性,研究者选择了不同部位样本进行类器官建模,结果发现不同部位来源的LCOs药敏结果略有差异(图3C)。以上结果表明,本研究构建的LCOs模型可以揭示起源肿瘤的一致性和异质性,有助于深层次了解肿瘤的表型和基因型特征,有利于筛选反映肿瘤表型和基因型全貌的更佳药物方案。
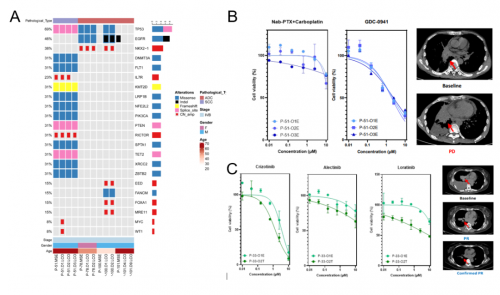
图3. LCOs模型的稳定性和异质性
LCOs模型可准确预测患者靶向或化疗反应
为了评价LCOs模型用来预测肺癌靶向或化疗反应的可行性,本研究利用基于类器官模型的靶向和化疗药物的敏感性试验结果来预测临床肿瘤疗效。结果表明,LCOs模型预测肺癌患者接受奥希替尼、化疗、双靶治疗和其他靶向治疗疗效的一致性分别为86.7%(13/15)、83.3%(10/12)、100%(10/10)和70.6%(12/17),总体的敏感性为84%、特异性为82.8%、准确性为83.3%(表1)。以上结果表明,LCOs可作为指导肺癌患者个性化靶向或化疗方案选择的预测模型。
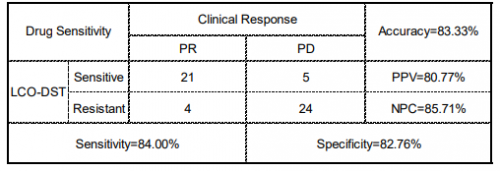
表1. LCOs体外反应与匹配患者临床反应的相关性
LCO-DST指导患者从双靶治疗中获益
本研究中纳入两例晚期肺腺癌双靶向基因变异患者:一例EGFR基因突变合并原发MET基因扩增(图4A),另一例EGFR基因突变合并获得性RET基因融合(图4B)。相比于单一靶向药物,两例患者的LCO-DST结果均显示联合靶向治疗(奥希替尼+赛沃替尼/卡博替尼)的肿瘤控制率更高,并且在临床治疗中得到证实,双靶联合治疗均达到了部分缓解(PR),表明双靶治疗可能是此类双基因变异人群的更优选择(图4C、D)。
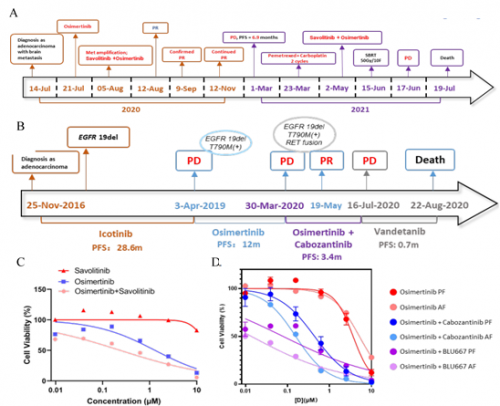
图4. LCO-DST指导患者从双靶治疗中获益
结语
本研究基于肺癌类器官的药敏试验准确地预测了该队列晚期肺癌患者抗肿瘤治疗的临床疗效,基于肺癌类器官的药敏试验可能是晚期肺癌非常有潜力的精准医学或个性化医疗的预测工具,基因检测作为类器官药敏实验中的分子检测技术,将持续为高质量类器官药敏实验保驾护航。
本研究使用了世和基因世和一号及百迈康NGS检测技术。
参考文献
Han-Min.Wang, Chan-Yuan Zhang, Kai-Cheng Peng, Ze-Xin.Chen, Jun-Wei Su, Yu-Fa Li, Wen-Feng Li, Qing-Yun Gao, Shi-Ling Zhang, Yu-Qing Chen, Qing Zhou, Cong Xu, Chong-Rui Xu, Zhen Wang, Jian Su, Hong-Hong Yan, Xu-Chao Zhang, Hua-Jun Chen, Yi-Long Wu, Jin-Ji Yang. Using patient-derivedor.ganoids to predict locally advancedor..metastatic lung cancer tumor.response: A real-world study. Cell Reports Medicine. 2023, 100911, ISSN 2666-3791. https://doi.org/10.1016/j.xcrm.2022.100911.
 17分!Cell子刊:NGS结合类器
17分!Cell子刊:NGS结合类器  【IF=20】ctDNA MRD技术
【IF=20】ctDNA MRD技术  【IF=8.6】Motif有效预测肺
【IF=8.6】Motif有效预测肺  案例报道 脑脊液ctDNA早于影像
案例报道 脑脊液ctDNA早于影像  案例报道 脑脊液ctDNA早于影像
案例报道 脑脊液ctDNA早于影像  ctDNA动态监测助力赛沃替尼精准用
ctDNA动态监测助力赛沃替尼精准用  ADJUVANT再添硕果:T细胞受体
ADJUVANT再添硕果:T细胞受体  世和MRD检测产品术宁Ultra重磅
世和MRD检测产品术宁Ultra重磅  泸州欣旺动物医院:成就宠物健康的典范
泸州欣旺动物医院:成就宠物健康的典范  全球国际医院集体来华, CMTF
全球国际医院集体来华, CMTF  数智融合,推进智慧医疗发展——星云基
数智融合,推进智慧医疗发展——星云基  若水堂:一片陈皮的升降浮沉、温热寒凉
若水堂:一片陈皮的升降浮沉、温热寒凉  “中国医药企业研发指数”发布 促进医
“中国医药企业研发指数”发布 促进医  推进智慧慢病管理 赋能数字健康发展|
推进智慧慢病管理 赋能数字健康发展|  第30届病案学术会议圆满成功,琴海
第30届病案学术会议圆满成功,琴海  精彩回顾|2023CACLP 圆满
精彩回顾|2023CACLP 圆满